Hereditäre Prädisposition
Haben Sie als Darmkrebserkrankter oder Darmpolypenträger Angehörige, so besitzen diese ein erhöhtes Risiko, auch an Darmkrebs zu erkranken. Aus diesem Grund sollten Familien dieses erhöhte Risiko frühzeitig realisieren und eine adäquate Darmkrebsvorsorge durchführen.
Prinzipiell unterscheidet man zwischen erblichen Darmkrebserkrankungen sowie familiär gehäuften Erkrankungen. Bei etwa 25 % der Patienten mit Dickdarmkrebs findet man eine familiäre Häufung der Erkrankung. Bei etwa 5 % der Patienten liegt eine der bekannten erblichen Formen von Dickdarmkrebs vor. Diese bekannten erblichen Tumorerkrankungen umfassen den erblichen Dickdarmkrebs ohne Auftreten multipler Darmpolypen, welcher als „Hereditary Non- Polyposis Colorectal Cancer“ = HNPCC oder Lynch-Syndrom bezeichnet wird und die erblichen Polyposis (Auftreten multipler Darmpolypen) -Syndrome. Hierzu gehören die Familiäre adenomatöse Polyposis (= FAP) sowie andere seltenere Syndrome.
Sind mehrere Personen aus einer Familie an einem kolorektalen Karzinom oder anderen Tumoren erkrankt, sollte der Verdacht auf eine erbliche Darmkrebserkrankung geäußert werden. Auch die Entwicklung von mehrfachen Tumoren bei einem Patienten oder eine Einzelerkrankung bei einem jungen Patienten können auf erblichen Darmkrebs hinweisen. Ziel genetischer Untersuchungen ist es, Risikopersonen zu identifizieren und einem engmaschigen Früherkennungsprogramm zuzuführen, während Risikopersonen, bei denen die Veranlagung zur Tumorerkrankung ausgeschlossen wurde, aus dem Früherkennungsprogramm zu entlassen, da sie kein höheres Tumorrisiko als die Allgemeinbevölkerung haben.
Für die einzelnen erblichen Darmkrebserkrankungen sind Veränderungen (Mutationen) in verschiedenen Genen bekannt. Bei Verdacht auf eine erbliche Tumorerkrankung in der Familie sollte eine humangenetische Beratung empfohlen werden. Nach Anfertigung einer ausführlichen Anamnese inklusive Stammbaumanalyse und der Dokumentation der aufgetretenen Tumorerkrankungen in der Familie können heutzutage gezielte molekulargenetische Untersuchungen durchgeführt werden.
Angeborener Nicht-Polypöser Dickdarmkrebs (HNPCC)
Keimbahnmutationen in den DNA-Mismatch-Reparaturgenen MLH1, MSH2, MSH6 und PMS2 sind die molekulargenetische Ursache für ein HNPCC-Syndrom. Am häufigsten werden Mutationen im MLH1 und MSH2-Gen nachgewiesen. Die Tumoren von HNPCC-Patienten zeigen charakteristischerweise (ca. 80-90%) eine hochgradige Mikrosatelliteninstabilität. Mikrosatelliten sind kurze repetitive DNA-Sequenzen, die sehr anfällig sind für Fehler, die während der Replikation der DNA auftreten können. Normalerweise werden diese Fehler durch ein intaktes DNA Mismatch-Reparatursystem repariert. Besteht ein Funktionsausfall eines dieser DNA-Mismatch-Reparaturgene im Tumor, können die Fehler nicht korrigiert werden und es kommt zum Auftreten zusätzlicher Allele, was als Mikrosatelliteninstabilität bezeichnet wird. Mikrosatelliteninstabilität kann jedoch auch in sporadisch auftretenden Kolonkarzinomen vorkommen (ca. 15%). Bei der Mikrosatelliten-analyse werden 5 Standardmikrosatellitenmarker untersucht. Zeigen mindestens 2 Marker eine Instabilität liegt eine hochgradige Mikrosatelliteninstabilität vor und es wird die Durchführung einer Keimbahnmutationsanalyse empfohlen. Zeigt nur ein Marker eine Instabilität wird eine erweiterte Mikrosatellitenuntersuchung mit einer Analyse von fünf weiteren Markern durchgeführt.
Die Untersuchung auf Mikrosatelliteninstabilität bei Verdacht auf HNPCC (Erfüllung der Bethesda-Kriterien) ist eine Präscreening-Untersuchung, die die Durchführung der anschließenden Mutationsanalysen auf die Patienten mit einem hochgradig instabilen Tumor beschränkt.
Parallel zur Mikrosatellitenanalyse wird eine immunhistochemische Untersuchung der Expression der 4 DNA-Reparaturgene im Tumor des Patienten durchgeführt. Das DNA-Reparaturgen, das bei HNPCC Patienten eine Keimbahnmutation aufweist, zeigt charakteristischerweise im Tumor des Patienten einen Expressionsverlust. Die immunhistochemische Untersuchung kann somit auf das Gen hinweisen, in dem die Keimbahnmutation präferentiell liegen könnte und erleichtert somit die weitere molekulargenetische Diagnostik. Nur durch den Nachweis einer Keimbahnmutation in einem der DNA-Mismatchreparaturgene wird die Diagnose eines HNPCC-Syndromes molekulargenetisch gesichert und es ergibt sich dann die Möglichkeit der prädiktiven Diagnostik von Familienmitgliedern, die noch nicht erkrankt sind.
Familienanamnestische Eingangskriterien zur molekularen Abklärung auf das Vorliegen eines HNPCC-Syndromes
Amsterdam-II-Kriterien
Alle Kriterien müssen erfüllt sein:
- Mindestens drei Familienangehörige mit histologisch gesichertem kolorektalen Karzinom oder einem Karzinom des Endometriums, Dünndarms, Ureters oder Nierenbeckens, davon einer mit den beiden anderen erstgradig verwandt, FAP muss ausgeschlossen sein.
- Wenigstens zwei aufeinanderfolgende Generationen betroffen
- Bei mindestens einem Patienten Diagnosestellung vor dem Alter von 50 Jahren
Revidierte Bethesda-Kriterien (Umar et al. 2004)
Mindestens ein Kriterium muss erfüllt sein:
- Kolorektales Karzinom unter 50 Jahren
- Synchrone oder metachrone kolorektale oder andere HNPCC-assoziierte Tumoren1, unabhängig vom Alter
- Kolorektales Karzinom mit MSI-H typischer Morphologie2 unter 60 Jahre.
- Patient mit kolorektalem Karzinom und mindestens einem erstgradig Verwandten mit einem HNPCC-assoziierten Tumor, ein Erkrankungsfall unter 50 Jahren
- Patient mit kolorektalem Karzinom und mindestens zwei erst- oder zweitgradig Verwandten mit HNPCC-assoziierten Tumoren1, unabhängig vom Erkrankungs-alter
1 HNPCC-assozierte Tumoren: Endometrium, Magen, Ovar, Pankreas, Dünndarm, Ureter und Nierenbecken, Gallengang, Gehirn (üblicherweise Glioblastome wie beim Turcot-Syndrom), Talgdrüsenadenome und Keratoakanthome (beim Muir-Torre-Syndrom).
2 Vorliegen von Tumor-infiltrierenden Lymphozyten, Crohn-ähnlicher lymphozytärer Reaktion, muzinöser/Siegelring-Differenzierung, oder medullärem Wachstum
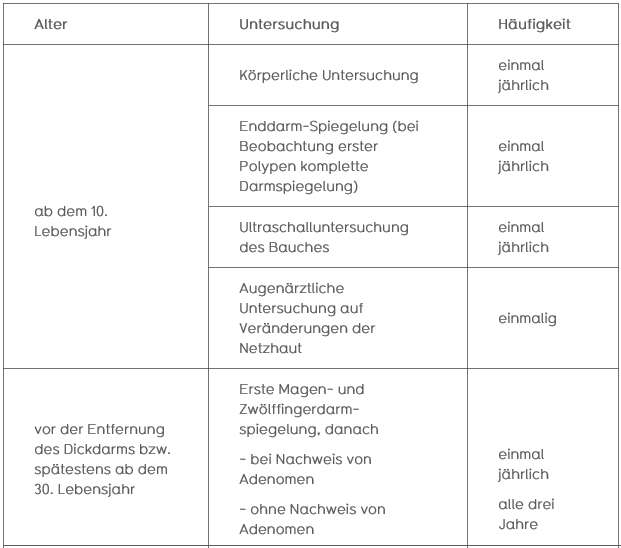
Je nach Ergebnis des molekulargenetischen Tests sollte Patienten und Familien mit einem HNPCC-Syndrom ein entsprechendes Tumorfrüherkennungsprogramm, das im Rahmen einer humangenetisch- klinischen Beratung erläutert wird, angeboten werden. Folgendes Früherkennungsprogramm wird für Personen mit erhöhtem Risiko empfohlen:
Familiäre adenomatöse Polyposis (FAP)
Die zweithäufigste Form des erblichen Darmkrebses ist die „Familiäre adenomatöse Polyposis“ (FAP). Sie ist durch das Auftreten von Hunderten von Polypen im gesamten Dickdarm gekennzeichnet. Das Polypenwachstum beginnt meist im 2. Lebensjahrzehnt am Übergang zwischen Dick- und Enddarm. Im Alter von ca. 40 Jahren entwickelt sich mit fast 100%iger Wahrscheinlichkeit ein Darmkrebs, wenn die Polypen nicht rechtzeitig entfernt wurden. Einige Patienten entwickeln zusätzlich auch Tumore außerhalb des Dickdarms (z.B. im Duodenum, im Magen, in Knochen). Bei etwa 85% der Patienten beobachtet man zudem eine charakteristische Veränderung der Netzhaut.
FAP wird autosomal- dominant vererbt und durch eine Mutation im Tumorsuppressorgen APC verursacht, die bei 80% der Patienten mit typischer FAP nachgewiesen werden kann.
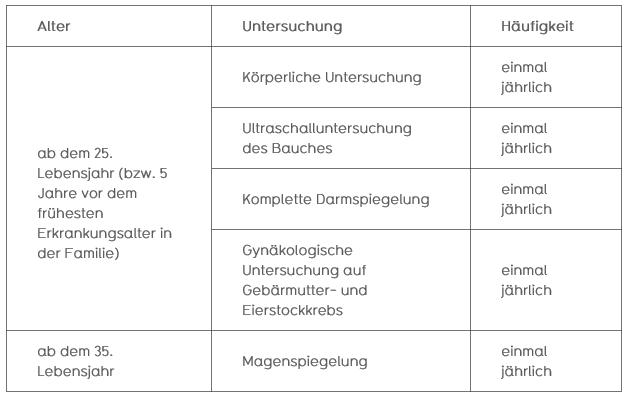
Beim FAP- Syndrom wird für Personen mit erhöhtem Risiko folgendes Früherkennungsprogramm empfohlen: